Današnja moderna medicina temelji se na kliničkim ispitivanjima. Svi lijekovi koji su nam dostupni prošli su klinička ispitivanja koja se provode u strogo kontroliranim uvjetima, na manjem broju osoba, kako bi se detaljno utvrdila njihova djelotvornost i potencijalne nuspojave te štetni učinci, te kako bi se lijek mogao dalje registrirati i primjenjivati.
Što su klinička ispitivanja?
Klinička ispitivanja su znanstveno-medicinska ispitivanja koja se provode na ljudima. U određenim fazama ispitivanja se provode na zdravim ispitanicima, a zatim na bolesnicima koji su dobrovoljno pristali na klinička ispitivanja.
Dva najvažnija aspekta u kliničkim ispitivanjima su ispitati djelotvornost i sigurnost lijeka, medicinskog proizvoda, dijagnostičke metode ili kirurških postupaka i načina liječenja. Ispituju se novi, ali i već odobreni lijekovi koji se mogu ispitivati u dodatnim indikacijama (kod drugih bolesti), u novim fazama iste bolesti, na posebnim podskupinama bolesnika i slično.
Kako se provode klinička ispitivanja?
Klinička ispitivanje se moraju provoditi prema strogim propisima koji ih reguliraju i prema definiranom planu ispitivanja.
Klinička ispitivanja lijekova u Republici Hrvatskoj provode se prema:
- Zakonu o lijekovima („Narodne novine“ broj 76/13, 90/14 i 100/18) i
- Pravilniku o kliničkim ispitivanjima lijekova i dobroj kliničkoj praksi („Narodne novine“ broj 25/15, 124/15 i 32/21)
U potpunosti su usklađeni s legislativnom Europske unije.
Podnositelj zahtjeva za provođenje kliničkog ispitivanja može biti:
- Naručitelj kliničkog ispitivanja sa sjedištem u Europskoj uniji, ili
- Ovlašteni predstavnik naručitelja kliničkog ispitivanja sa sjedištem u Europskoj uniji, ako je naručitelj izvan Europske unije
Moguće je provesti i neprofitna klinička ispitivanja. Takva ispitivanja ispitivač provodi bez sudjelovanja farmaceutske industrije. Neovisno o vrsti kliničkog ispitivanja (profitno ili neprofitno), sve fizičke i pravne osobe uključene u ispitivanje trebaju slijediti stroge međunarodne i nacionalne zakone i propise u cilju najvišeg stupnja zaštite ispitanika u kliničkim ispitivanjima.
Prije početka kliničkog ispitivanja, naručitelj ispitivanja, odnosno podnositelj zahtjeva treba predati kompletnu dokumentaciju o provođenju ispitivanja i ispitivanom lijeku Središnjem etičkom povjerenstvu (SEP) koje utvrđuje zadovoljava li navedeno ispitivanje etička načela. Povjerenstvo je neovisno tijelo sastavljeno od renomiranih stručnjaka iz različitih grana medicine, znanstvenika, pravnika i drugih članovi nemedicinske struke čija je zadaća štititi prava, sigurnost i dobrobit ispitanika uključenih u klinička ispitivanja, te donošenje odluke o etičkoj prihvatljivosti ispitivanja. Pri donošenju odluke o etičnosti ispitivanja, s posebnom pažnjom se procjenjuje opravdanost predvidivih opasnosti i rizika u odnosu na pretpostavljene koristi za ispitanike, pri čemu koristi za ispitanika moraju biti veće od mogućih šteta i potencijalnih nuspojava (pored dokazanog korisnog učinka, svaki lijek ima i potencijalne nuspojave ili neželjene učinke lijeka).
Također, Povjerenstvo ocjenjuje zadovoljava li zdravstvena ustanova u kojoj će se provoditi kliničko ispitivanje uvjete za provođenje takvog ispitivanja, te kvalifikacije ispitivača u smislu posjedovanja stručnog znanja i iskustva u liječenju pacijenata. Ustanove i ispitivače u kliničkom ispitivanju određuje isključivo naručitelj kliničkog ispitivanja. U ugovoru kojeg naručitelj kliničkog ispitivanja sklapa sa zdravstvenom ustanovom utvrđuju se, između ostalog, naknade za putne troškove ispitanika, kao i obveza naručitelja da snosi troškove svih dijagnostičkih i terapijskih postupaka u sklopu kliničkog ispitivanja.
Tko odobrava klinička ispitivanja?
Ministarstvo zdravstva je nadležno regulatorno tijelo koje odobrava sva klinička ispitivanja u Republici Hrvatskoj. Prije izdavanja odobrenja, Ministarstvo zdravstva ocjenjuje dokumentaciju koja je prethodno dobila pozitivno mišljenje o provođenju kliničkog ispitivanja od Središnjeg etičkog povjerenstva (SEP).
U godinama prije pandemije COVID-19, u Hrvatskoj je godišnje bilo odobreno između 50 do 60 novih kliničkih ispitivanja lijekova i medicinskih proizvoda. U pandemijskoj 2020. godini, radi sprečavanja širenja zaraze i potrebe za reorganizacijom zdravstvenog sustava u svrhu zaštite zdravlja i života bolesnika, pa tako i potencijalnih ispitanika u kliničkim ispitivanjima, Ministarstvo zdravstva je na nekoliko mjeseci privremeno obustavilo odobravanje novih kliničkih ispitivanja.
Odobravanje novih kliničkih ispitivanja u 2020. godini trajalo je oko dva mjeseca, nakon čega je SEP krenuo s online radom i redovnim online sjednicama svaka dva tjedna. Te je godine odobreno 43 klinička ispitivanja, uključujući lijekove za COVID-19 i liječenje njegovih nuspojava. Prethodno odobrena klinička ispitivanja, kao i novoodobrena ispitivanja u tijeku, dobila su novi oblik koji je odgovarao okolnostima:
- informirani pristanci su se mogli ishoditi online do prve posjete ispitivačkom centru, kad su ih ispitanici morali potpisati osobno,
- ispitanici su mogli raditi pretrage krvi i ostalih bioloških uzoraka u svojim lokalnim laboratorijima,
- organizirane su posjete za davanje lijeka kod kuće,
- organizirana je dostava ispitivanih lijekova u kuću,
- organiziran je prijevoz ispitanika do ispitivačkih centara,
- organizirane su telemedicinske posjete za praćenje i slično.
Kako se provodi registracija lijeka?
Nakon uspješno završenog, u pravilu višegodišnjeg pretkliničkog i kliničkog istraživanja, potrebna je registracija lijeka kod regulatornih institucija kao što su američka FDA (U.S. Food and Drug Administration), europska EMA (European Medicines Agency) i hrvatski HALMED (Agencija za lijekove i medicinske proizvode). Nakon registracije lijeka kreće četvrta faza kliničkih istraživanja u kojoj se lijek intenzivno prati kako bi se detaljno prikupljale informacije o učinkovitosti lijeka i eventulane nove nuspojave kod opće populacije koja prima lijek. Izvješća o terapijskom učinku se prezentiraju na kongresima, simpozijima, u publikacijama.
Područje kliničkih ispitivanja u Hrvatskoj regulirano je Zakonom o lijekovima i Pravilnikom o kliničkim ispitivanjima lijekova i dobroj kliničkoj praksi.
Sukladno članku 129. Zakona o lijekovima, HALMED kao središnja Agencija za lijekove i medicinske proizvode u Hrvatskoj daje administrativnu suglasnost za izvanredni unos/uvoz lijeka koji se koristi u kliničkim ispitivanjima, a koji još nije registriran i stavljen u promet u Hrvatskoj. Također, pruža administrativnu podršku SEP-u.
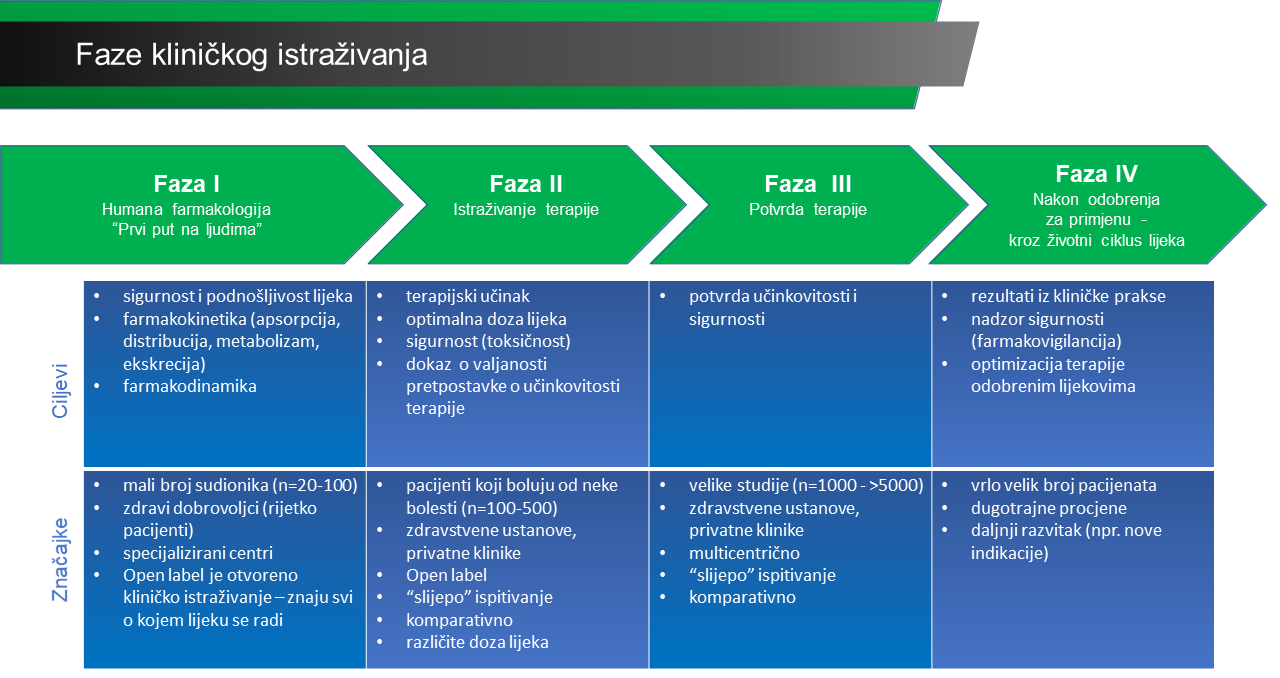
Koje su faze kliničkog ispitivanja?
Ispitivanja prve faze su početna ispitivanja kada lijek dođe iz pretkliničkih ispitivanja (na staničnim linijama ili eksperimentalnim životinjama) na ispitivanja na manjem broju ljudi (najčešće na zdravim dobrovoljcima). Cilj te faze je ispitati podnošljivost i ponašanje lijeka na čovjeka. U drugoj fazi ispituje se da li lijek ima željeni terapijski učinak na bolesnika uz prihvatljive štetne događaje. Postupno se proširuje na veći broj bolesnika, na različite faze bolesti. Cilj ove faze je utvrditi koja razina lijeka je potrebna da bi bio učinkovit, a najmanje štetan. Nakon faze dva, slijedi faza tri koja nastoji obuhvatiti što više bolesnika, u što više medicinskih centara. Cilj ove faze je utvrditi prednost novog lijeka nad već poznatom terapijom. Četvrta faza provodi se nakon registracije lijeka.
Izvor: EUPATI, Basics of Early Clinical Development; Prijevod izvornika: Mira Armour, Paula Georgev
Gdje se provode klinička ispitivanja?
Klinička ispitivanja u Republici Hrvatskoj provode se u kliničkim bolnicama i specijaliziranim klinikama za liječenje pojedinih bolesti za koje se ispituju navedeni lijekovi i koje posjeduju najveću „koncentraciju“ znanstveno-istraživačkog liječničkog kadra. Provode se i u općim bolnicama koje po znanju i iskustvu zdravstvenog osoblja zadovoljavaju kriterije za provođenje kliničkih ispitivanja lijekova.
Kako se uključiti u klinička ispitivanja?
Ispitanici u kliničkim ispitivanjima uglavnom su pacijenti koji se liječe u zdravstvenoj ustanovi kojoj je odobreno provođenje kliničkog ispitivanja. Pacijenti koji zadovoljavaju kriterije za uključivanje u kliničko ispitivanje trebaju dati svoju pismenu suglasnost, odnosno potpisati Informirani pristanak – opsežan i detaljan dokument u kojem su navedene sve prednosti, nedostaci, potencijalne koristi i nuspojave, te rizici sudjelovanja u tom kliničkom ispitivanju. Kad se netko odluči sudjelovati u kliničkom ispitivanju kao ispitanik, on u svakom trenutku može odustati od kliničkog ispitivanja bez posljedica za svoje daljnje liječenje.
U klinička ispitivanja u Republici Hrvatskoj najčešće se uključuju razni onkološki bolesnici, potom bolesnici koju boluju od shizofrenije, raznih infektivnih bolesti, šećerne bolesti, reumatoidnog artritisa, multiple skleroze, astme, kronične opstruktivne plućne bolesti, bipolarnog i velikog depresivnog poremećaja, hemofilije, Alzheimerove bolesti, ulceroznog kolitisa i Chronove bolesti, te drugih.
U proteklih nekoliko godina u Republici Hrvatskoj se provelo samo jedno kliničko ispitivanje u indikaciji multiplog mijeloma.
Valja napomenuti kako isključivo naručitelj kliničkog ispitivanja donosi odluku o izboru države i zdravstvene ustanove u kojoj će se provoditi kliničko ispitivanje, kao i o izboru glavnih ispitivača za pojedino kliničko ispitivanje, te o ukupnom broju ispitanika u određenoj državi.
Koje su prednosti kliničkih ispitivanja s aspekta pacijenta?
Klinička ispitivanja ispitaniku pružaju priliku za aktivnu skrb o vlastitom zdravlju (proaktivno traže kliničke studije u koje bi se mogli uključiti nastojeći doći do lijeka koji im inače ne bi bio dostupan). Ispitanik može imati izravnu korist jer će imati pristup liječenju koje inače ne bi mogao dobiti (npr. najnoviji lijekovi protiv raka ili koje ne pokriva zdravstveno osiguranje). Doprinosi medicinskim istraživanjima od kojih veliku korist mogu imati drugi oboljeli i budući bolesnici. Također, kad je ispitanik uključen u kliničko ispitivanje često mu se pruža dodatna razina zdravstvene skrbi, iznad uobičajene kliničke prakse.
Koji su potencijalni rizici sudjelovanja u kliničkim ispitivanjima?
- Nedjelotvornost ispitivanog lijeka
- Štetni učinci, odnosno nuspojave lijeka koji se ispituje
- Rizici povezani s postupcima koji se provode u ispitivanju
- Mogućnost dobivanja placeba, a ne ispitivanog lijeka (Ako primjena placeba nema primjeren učinak liječenja, ispitanik se na vrijeme isključuje iz ispitivanja ili počne s dobivanjem aktivnog lijeka. U liječenju težih bolesti dobivanje placeba je prihvatljivo samo uz standardno liječenje)
Svaki ispitanik u kliničkom istraživanju ima pravo na samostalno i slobodno odlučivanje o sudjelovanju u kliničkom ispitivanju, pravo na povlačenje iz kliničkog ispitivanja u bilo kojem trenutku bez negativnih posljedica i gubitka prava na liječenje, pravo na potpune, točne i razumljive informacije o ispitivanjima te pravo na zaštitu privatnosti podataka.
Gdje se mogu prikupiti informacije o dostupnim kliničkim ispitivanjima?
Od 2010. godine Ministarstvo zdravstva, kao nadležno regulatorno tijelo koje odobrava klinička ispitivanja, na svojim mrežnim stranicama objavljuje i redovito ažurira popise odobrenih kliničkih ispitivanja u Republici Hrvatskoj s njihovim trenutnim statusom. Informacije su dostupne na ovom linku: https://zdravlje.gov.hr/o-ministarstvu/djelokrug-1297/lijekovi-i-medicinski-proizvodi/1349
Navedene popise moguće je pretraživati po određenim parametrima:
- Ispitivanim lijekovima
- Indikacijama u kojima se lijek ispituje
- Odobrenim ispitivačkim centrima, te
- Statusu ispitivanja
S danom pristupanja Europskoj uniji, Republika Hrvatska kao punopravna članica ima obavezu unošenja podataka o odobrenom i odbijenim kliničkim ispitivanjima u Republici Hrvatskoj u europsku bazu podataka o kliničkim ispitivanjima (eng. EU Clinical Trial Register). Podaci iz europskog registra (o odobrenim kliničkim ispitivanjima, njihovima rezultatima, te ispitivanim lijekovima) mogu se pretraživati na ovom linku: https://www.clinicaltrialsregister.eu/ctr-search/search
Pacijenti u Republici Hrvatskoj informacije o kliničkim ispitivanjima mogu dobiti i kod svog nadležnog liječnika.
Zaključak
Sudjelovanje u kliničkim ispitivanjima važno je ne samo radi dobivanja uvida u rezultate određenog tretmana i napretka medicinske znanosti, već i radi vrijednih informacija o tome kako poboljšati kvalitetu života pacijenta tijekom određenog liječenja.
Ostale korisne informacije i linkovi
- HALMED – Agencija za lijekove i medicinske proizvode. Obratiti pažnju na Pacijenti i javnost. HALMED-ov djelokrugu rada obuhvaća i:
- analizu i ocjenu nuspojava i sigurnost ispitanika u kliničkim ispitivanjima, te
- analizu i ocjenu štetnih događaja u kliničkim ispitivanjima medicinskih proizvoda
- Roche – biotehnološka tvrtka sa sjedištem u Švicarskoj. Na stranici obratite pažnju na Informacije o kliničkim ispitivanjima.
- EMA – Europska agencija za lijekove – obratiti pažnju na Clinical Trial Regulation (na engleskom)
- U.S. National Library of Medicine – registar svih privatno i institucijski financiranih kliničkih istraživanja u svijetu dostupan je na stranicama Američke nacionalne medicinske knjižnice (na engleskom)
Sadržaj stranice kreiran je na temelju relevantnih informacija prikupljenih od Ministarstva zdravstva, Hrvatske agencije za lijekove i medicinske proizvode – HALMED, te predavanja doc. prim. dr. sc. Dražena Pulanića na temu kliničkih ispitivanja u Hrvatskoj.